SIE HABEN ODER KENNEN JEMANDEN MIT COPD?
Wir fassen auf dieser Seite alle wichtigsten Infos zusammen.
4900 Worte | 20 Minuten Lesezeit
Lieber Kunde, Patient und/oder (Fach)Arzt, wir wollen dir zu verschiedenen Diagnosen und Verletzungen einen Einblick in die Problematik, unser Vorgehen und unsere Behandlung geben. Hierfür beziehen wir uns auf wissenschaftliche Studien und unsere jahrelange Erfahrung. So kannst du dich vorab schon besser informieren und offene Fragen oder mögliche Unsicherheiten klären.
COPD steht für die englische Benennung Chronic Obstructive Pulmonary Disease und ist eine nicht heilbare, dauerhafte, atemwegsverengende Lungenerkrankung. Etwa 10% der erwachsenen Bevölkerung ist an COPD erkrankt, Tendenz steigend.1 COPD ist die 3. häufigste Todesursache weltweit3. Die Krankheit kann somit als ein globales Gesundheitsproblem bezeichnet werden. Die „Globale Initiative für COPD“ (GOLD) veranstaltet jedes Jahr einen World COPD Day, um über die Krankheit aufzuklären und das Bewusstsein der Bevölkerung dafür zu sensibilisieren.
WIE ENTSTEHT DIE PROBLEMATIK?
RISIKOFAKTOREN
Da die Bevölkerung immer älter wird und Risikofaktoren tendenziell zunehmen, erhöhen sich auch die Fallzahlen zunehmend. Infektionen und kardiologischen Erkrankungen, Bewegungsarmut und auch der Konsum von Tabak steigen uns erhöhen das Risiko einer Erkrankung. Es gibt sowohl Risikofaktoren, die man selbst beeinflussen kann, als auch Risikofaktoren, die weniger gut selbst beeinflussbar sind.
Rauchen ist der grösste Risikofaktor für die Entwicklung von COPD. Nicht nur das Rauchen von Zigaretten, sondern auch Zigarren und Wasserpfeifen oder auch passives rauchen können Auslöser sein.3 Diesen Risikofaktor kann man zum grössten Teil gut selbst beeinflussen. Auch sein Umfeld kann man gut schützen, indem man niemanden passivem Rauchen aussetzt.
Die Genetik spielt ebenfalls eine weitere wichtige Rolle. Eine schlechte Lungenentwicklung (tritt auf bei 4-12% der Menschen) und niedrige Lungenfunktion in jungem Erwachsenenalter ist ein Risikofaktor. Hierzu gibt es noch sehr wenig Studien, aber es wurde herausgefunden, dass sich bei 50% der Patienten mit COPD die Krankheit aufgrund von abnormalem Lungenwachstum entwickelt3.
Die Lunge entwickelt sich fortwährend und hat den Höchststand der Entwicklung und Funktion im Alter von 25 Jahren erreicht. Zu diesem Zeitpunkt hat die Lungenfunktion ein Plateau erreicht und wird mit zunehmendem Alter langsam schlechter. Umwelteinflüsse in jeder dieser Phasen haben positive oder negative Auswirkungen auf diese Kurve.1,4 Alkoholkonsum unter 15 Jahren sowie rauchen in der Schwangerschaft erhöhen das Risiko für den Fötus in Bezug auf Lungenwachstum und Entwicklung. Ebenso spielen negative Beeinflussungen des Immunsystems4 oder schwere Atemwegsinfektionen in der Kindheit eine Rolle. Für eine gute Lungenentwicklung sind somit in der Regel die Eltern / Erziehungsberechtigten zu einem grossen Teil mit verantwortlich.
Ein weiteres Risiko besteht im Einatmen von chemischen Partikeln, von Substanzen die z. B. freigesetzt werden während Holzverbrennung, Düngerverwendung, Arbeiten mit Asbest oder viel Staub. Aber auch die Luftverschmutzung in Innenräumen durch Öfen, Heizen und Kochen mit Biomasse4. Hier ist besonders in Entwicklungsländern die Tendenz steigend3. Durch das Tragen von geeigneter Schutzkleidung bei solchen Arbeiten kann das Risiko deutlich reduziert werden.
Die gesundheitliche Vorgeschichte eines Menschen spielt zudem eine grosse Rolle. Vorerkrankungen wie Asthma5, Allergien, Tuberkulose, HIV-Infektion, häufiges Auftreten von Sinusitis (Nasennebenhöhlenentzündung) oder Lungenentzündungen und Obesitas (Übergewicht) sind wichtige Faktoren.
Auch ungesunde Ernährung (zuckerhaltig, wenig Obst und Gemüse), Depressionen, Hypertension (Bluthochdruck), hohe Entzündungswerte, Bewegungsmangel (weniger als 60 min. körperliche Aktivität pro Tag im Alter zwischen 60-85 Jahren), Diabetes oder periphere Durchblutungsstörungen erhöhen das Risiko an COPD zu erkranken.1 Die erbliche Stoffwechselerkrankung Alpha 1 Antitrypsin Mangel zählt auch zu einem wichtigen Risikofaktor für die Entwicklung von COPD. Liegt der Wert <20% vom Durchschnittswert, sollten auch Familienmitglieder untersucht werden.6
Ein niedriger Bildungsstand, kognitive Einschränkungen und ein niedriger Beruf sind ebenfalls Risikofaktoren für das Entwickeln von COPD1.
Hier ist es gut möglich, die Risikofaktoren zu minimieren, nämlich durch einen gesunden Lebensstil mit gesunder Ernährung, viel Sport und Bewegung. So wird das Risiko an Übergewicht, Infektionen, Depressionen, Bluthochdruck und Entzündungen minimiert und somit sinkt auch das Risiko, an COPD zu erkranken.
SYMPTOME
- Kurzatmigkeit (progressive Verschlechterung, schlechter bei Anstrengung, persistent,4 Ausatmen vor allem erschwert1
- Chronischer Husten (intermittierend, unproduktiv)
- Schleim, schlechtes abhusten (abgrenzen von chronischer Bronchitis)
- Müdigkeit, geringe Belastbarkeit, Gewichtsverlust4
- Brustkorb Steifheit, Haltungsverfall (Fassthorax)
DIAGNOSE
Um COPD zu diagnostizieren wird die medizinische Vorgeschichte des Patienten im Hinblick auf Risikofaktoren zusammengetragen. Diese Auflistung sollte Folgendes enthalten:4
- Vorhandene Risikofaktoren, schädliche Umwelteinflüsse
- Medizinische Vorgeschichte in Bezug auf Asthma, Allergien, Sinusitis, Polypen, Atemwegsinfektionen in der Kindheit, andere chronische Atemwegserkrankungen oder chronische Erkrankungen
- Familiengeschichte COPD oder andere chronische Atemwegserkrankungen
- Entwicklung und Abhängigkeiten der Symptome
- Exazerbationen oder Krankenhausaufenthalte aufgrund von Atemwegsbeschwerden (dies wird später detaillierter erläutert)
- Komorbiditäten sowie kardiologische Erkrankungen, Osteoporose, Muskuloskelettale Probleme, Malignität
- Impakt der Krankheit auf den Alltag, Einschränkungen in Aktivitäten und Partizipation, Sorgen und Ängste
- Soziales Umfeld, familiäre Unterstützung
- Möglichkeiten und Ressourcen um die Risikofaktoren zu minimieren
Das Vorhandensein von den oben aufgelisteten Symptomen und Risikofaktoren ersetzt nicht die weitere Diagnostik, erhöht aber die Wahrscheinlichkeit auf eine Diagnose von COPD.
Der Lungenfacharzt kann einen Lungenfunktionstest (Spirometrie) durchführen, um zwei bestimmte Werte zu untersuchen. Bei Atemwegseinschränkungen müssen beide Werte niedrig sein.
- FEV1 ist das Lungenvolumen, welches innerhalb von einer Sekunde ausgeatmet werden kann
- FVC ist das totale Lungenvolumen eines gesamten Ausatemzuges nach maximaler Einatmung
Beim Post-Bronchodilator Spirometrie Test wird der FEV1 Wert ermittelt. Dann wird ein Bronchodilator (Basismedikament zum Inhalieren bei COPD, erweitert die Bronchien, vereinfacht das Atmen) verabreicht. Im Anschluss wird15 Minuten gewartet und der Test wird wiederholt. Unterscheiden sich die Werte <0,7, ist eine Atemeinschränkung vorhanden.
Beim Lungenfacharzt kann auch die Funktion der Atemmuskulatur getestet werden. Hierfür werden der maximale statische Inspirations- und Expirationsdruck sowie der Mundverschlussdruck getestet.26 Bei der Bestimmung des Mundverschlussdrucks wird bei begonnener Einatmung ein Ventil vor dem Mund verschlossen und dann der Munddruck gemessen. Zudem wird dieser Test dann auch noch während maximaler Ein- und Ausatmung durchgeführt.
Zusätzlich kann mittels verschiedener Fragebögen die Ausprägung der Atemnot und den Einfluss auf das alltägliche Leben ermittelt werden. Hierfür werden folgende Fragebögen empfohlen:
- Modified British Medical Research Council Questionnaire4
- COPD Assessment Test (CAT)
Ziel der Untersuchungen ist, den aktuellen Status der Atemeinschränkung zu messen und den Einfluss der Krankheit auf den allgemeinen Gesundheitszustand des Patienten zu ermitteln. Hierdurch kann eine Risikoeinschätzung von zukünftigen Ereignissen wie Exazerbationen und Krankenhausaufenthalten gemacht werden sowie eine Prognose zur Lebenserwartung gestellt werden.
Ausserdem ist es wichtig, begleitende Erkrankungen zu untersuchen und zu behandeln. Hierzu erfährst du später noch genauer, welche Krankheiten oft in Verbindung mit COPD stehen.
Weitere zusätzliche diagnostische Mittel können helfen, andere Krankheiten auszuschliessen oder dabei unterstützen, die richtige Therapie bei COPD zu finden:
- Röntgen, CT vom Brustkorb
- Finger Pulsoximeter zur Ermittlung der Sauerstoffsättigung im Blut
- Arterielle Blutsauerstoffmessung
- Peak-Flow Messung zur Bewertung von Atemnot
- Belastungstests (hier gehen wir aus physiotherapeutischer Sicht später genauer darauf ein)
- Blutbild
Klassifikation
Die Diagnose nach dem COPD-Gold-Assessment-Tool erfolgt durch den Post-Bronchodilatator-Test. Anhand des Wertes FEV1 wird GOLD 1-4 vergeben für die schwere der Atmungseinschränkung. Ausserdem werden auch die Symptome durch die oben erwähnten Fragebögen und die Anzahl an Exazerbationen berücksichtigt. Die Einstufung von A bis D hängt von der Anzahl der Exazerbationen und der Schwere der Symptome laut Fragebögen ab.
Prognose
Um eine prognostische Aussage über das Exazerbationsrisiko zu machen, kann ein Blutbild erstellt werden. Hier weist eine erhöhte Anzahl an Eosinophilen im Blut auf ein erhöhtes Exazerbationsrisiko hin. Mehrere Exazerbationen in der Krankengeschichte und vor allem wenn Exazerbationen einen Krankenhausaufenthalt mit sich ziehen, verschlechtern die Prognose der COPD und erhöhen das Sterberisiko4. Allgemein lässt sich prognostisch sagen, dass mit der Erkrankung COPD eine frühe Multimorbidität und eine verkürzte Lebenserwartung einhergehen1. Für weitere Aussagen zur Prognose des Krankheitsverlaufes und der Sterblichkeit kann zur Patientenaufklärung der BODE-Index mittels eines Fragebogens bestimmt werden28. Dieser berücksichtigt den FEV1-Wert, die Ergebnisse des 6 Minuten Geh-Tests, die Atemnot und den BMI.
ANATOMIE/ PATHOPHYSIOLOGIE
Anatomie
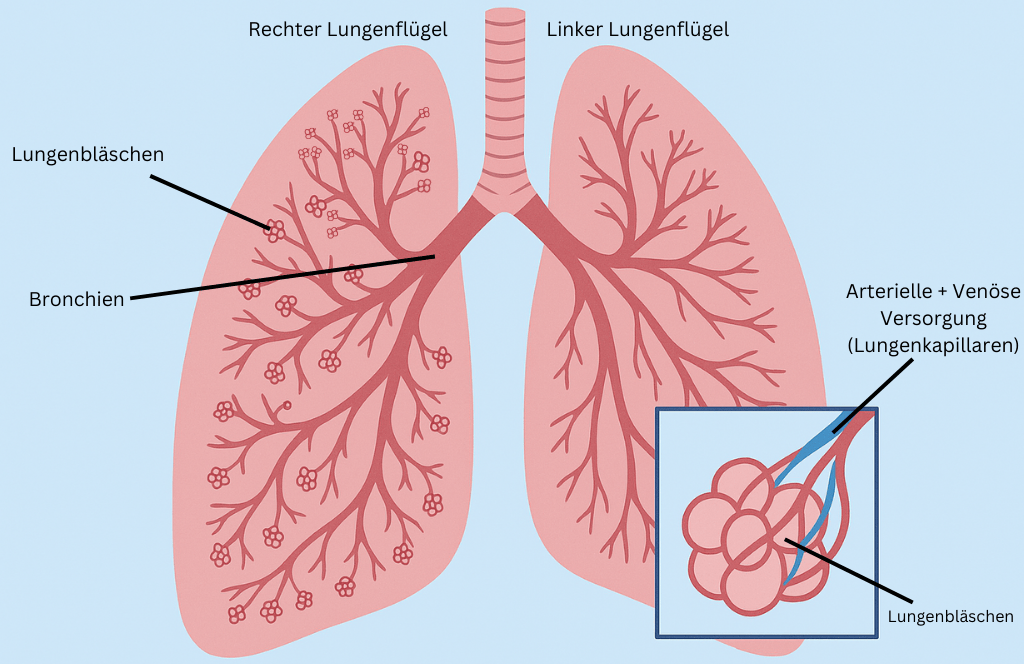
Die Lunge besteht aus einem rechten Lungenflügel und einem linken Lungenflügel. Der rechte Lungenflügel wird aus drei Lungenlappen gebildet und der linke Lungenflügel aus zwei Lungenlappen, damit das Herz genug Platz hat.
Wenn man das Bild über Kopf betrachtet, ist die Lunge aufgebaut wie ein umgedrehter Baum. Die Trachea (Luftröhre) bildet den Stamm und von ihr gehen zwei Hauptäste ab, die Bronchien. Diese sind noch in kleinere Äste und Zweige unterteilt und enden mit Alveolen (Lungenbläschen) die wie Trauben an einer Rebe angeordnet sind. Die 200-300 Millionen Lungenbläschen pro Lunge sind mit kleinen Wegen miteinander verbunden und mit einem Netz aus Kapillaren (Haargefässe) überzogen.
Die Hauptfunktion der Lunge ist die Atmung. Hier findet der Gasaustausch statt. Die Atmung wird jedoch nicht allein von der Lunge durchgeführt, sondern auch von anderen Strukturen:
- Der Brustkorb dient als Schutz der Lunge, er ist sein bewegliches Gerüst. Ebenfalls wichtig ist die Kraftübertragung während der Atmung. Die Rippen und das Brustbein heben und senken sich bei der Atmung.
- Die Atemmuskeln bewegen den Brustkorb bei der Atmung. Bei verminderter Kraft und Ausdauer der Atemmuskeln, verringert sich das Atemzugvolumen und Atemminutenvolumen.
- Der wichtigste Atemmuskel, das Zwerchfell/ Diaphragma, bewegt sich bei jedem Atemzug im Optimalfall 10-12cm.
- Andere Atemhilfsmuskeln sind verschiedene Inspirationsmuskeln, die bei der Einatmung helfen indem sie den Brustkorb anheben. Diese befinden sich an der Rückseite des Brustkorbes. Zudem helfen die Expirationsmuskeln dabei, den Brustkorb wieder zusammenzuziehen und befinden sich an der Vorderseite des Brustkorbes.
Gasaustausch
In den Kapillaren (Haargefässen) findet der Austausch von Sauerstoff aus den Lungenbläschen und CO2 aus den Blutgefässen statt:
Der Sauerstoff aus der eingeatmeten Luft strömt durch die Lungenbläschen und Kapillaren ins Blut ein und bindet sich dort an den Sauerstoff in den roten Blutkörperchen. Von da aus wird der Sauerstoff weitergeleitet, zu den Stellen im Körper, die konstant mit Sauerstoff versorgt werden (Muskeln, Gehirn, etc.). Im Austausch wird CO2 von den roten Blutkörperchen aufgenommen, zur Lunge transportiert und abgeatmet.
Durch die Atmung werden essentielle Stoffwechselprogramme durchgeführt, die für unsere Körperfunktionen überlebenswichtig sind. Der Gasaustausch ist ein wichtiger Bestandteil für die Energiegewinnung im Körper sowie für die Zellatmung.
Pathophysiologie
Die Erkrankung umfasst in der Lunge hauptsächlich die kleinen Atemwege und die Lungenbläschen. Hier ist eine durchgehende Entzündung zu beobachten sowie ein Ungleichgewicht zwischen Einatmung und Ausatmung, welches zu oxidativem Stress führt.
Die Schleimhäute und Schleimdrüsen sind chronisch entzündet, nehmen an Grösse zu und starten eine Überproduktion von Schleim. Des weiteren wird die oberste Schicht der Lungenbläschen verletzt.
Im Laufe der Erkrankung nimmt die Elastizität des Lungengewebes ab und die Flimmerhärchen verlieren ihre Beweglichkeit. Hierdurch wird der elastische Rückstoss-Druck in der Lunge reduziert, welcher dafür sorgt, dass die Lunge beim Ausatmen nicht kollabiert. Die Atemwege verengen sich, die Atmung verringert sich und die Luft bleibt in den Lungen eingeschlossen (Trapped Air).
Diese fibrotischen Veränderungen der Lunge und der Atemwege schreiten voran. Man spricht von einer Lungenfibrose: Das funktionierende Lungengewebe wird schrittweise ersetzt durch funktionsloses Bindegewebe, welches man mit Narbengewebe vergleichen kann. Dadurch sind die Veränderungen in den Atemwegen dauerhaft und unumkehrbar. Trotz Bronchodilatoren (Medikamente, die die Bronchien erweitern) herrscht ein vergrösserter Atemwiderstand und die Atmung wird zunehmen erschwert.
Zunehmend reduziert sich die Oberfläche der Lungenbläschen. Diese werden zwar grösser, verschmelzen jedoch miteinander. Diesen Zustand bezeichnet man nun als Lungenemphysem. Der Gasaustausch kann nicht mehr uneingeschränkt stattfinden und die Atmung gerät zunehmend in ein Ungleichgewicht. Dies äussert sich dadurch, dass der Druck der Ausatemluft weniger wird als der Atemwiderstand der verengten Gefässe und die Ausatmung erschwert wird. Dadurch wird nicht die ganze Luft ausgeatmet und es kommt zu einer Hyperinflation (Lungenüberblähung). Dies ist der Hauptgrund für die Kurzatmigkeit und die somit niedrige Lebensqualität. Anatomisch lässt sich bei den Patienten ein Fass-förmiger Brustkorb erkennen.
Der Verlauf der Krankheit ist progredient (zunehmend schlechter) und geht einher mit verschiedenen Folgekrankheiten. Zudem können noch Exazerbationen auftreten, das sind akute Verschlechterungen des Gesundheitszustandes und des Krankheitsverlaufes. Diese werden meist ausgelöst durch virale oder bakterielle Infektionen oder andere Umwelteinflüsse. Exazerbationen zeigen sich durch starke Symptomverschlechterungen, die meist 7-10 Tage anhalten. Ab einer Dauer von 8 Wochen rehabilitieren 20% der Patienten nicht mehr zu ihrem vorherigen Status.13 Die Symptome können sich in einer erhöhten Atemwegsentzündung, erhöhten Schleimproduktion, Air Trapping (Luft bleibt in den Alveolen eingeschlossen und kann nicht ausgeatmet werden) sowie erhöhter Atemnot zeigen.4 Exazerbationen lassen sich einteilen in mild, moderat (Behandlung ambulant durch Medikamente) und schwer (Behandlung stationär). Ist eine stationäre Behandlung notwendig oder liegt die Häufigkeit von Exazerbationen bei zwei oder mehr pro Jahr haben diese Patienten eine schlechtere Lebenserwartung. 14 Nach einer Exazerbation ist für einen Monat das Risiko erhöht von kardiovaskulären Ereignissen: Brustenge, Herzinfarkt, Schlaganfall.
COPD ist eine systemische Krankheit, das heisst, dass nicht nur lokal in der Lunge Probleme entstehen, sondern Auswirkungen auf den kompletten Körper hat. Daher steigt die Wahrscheinlichkeit immens, verschiedene Komorbiditäten zu entwickeln. Die häufigsten werden hier aufgelistet, da es wichtig ist, dass diese erkannt und behandelt werden und auch für unsere Therapie eine grosse Rolle spielen.
Durch ein Ungleichgewicht zwischen Energieaufnahme und Energieverbrauch geht COPD mit starkem Gewichtsverlust und Abbau von Muskelmasse einher. Anhaltende Entzündungsprozesse führen zu einer Verringerung des Appetits und einer Erhöhung des Ruheenergieumsatzes. Des weiteren wird der Muskelstoffwechsel negativ beeinflusst, wodurch das Gleichgewicht zwischen Regeneration und Zelltod gestört ist und es zu Veränderungen der Muskelfasern kommt. Die Muskulatur verliert an Ausdauer und das Zwerchfell an Kraft. Für dasselbe Ausmass an körperlicher Belastung brauchen COPD-Erkrankte mehr Energie als gesunde Menschen und der Aufbau von Muskelmasse und Kraft ist schwieriger. (30 gesamter Abschnitt)
Das Air Trapping (Restluft in der Lunge) und dadurch ständige Druckschwankungen, können negative Auswirkungen auf das Kardiovaskuläres System haben. Der diastolische Druck wird beeinflusst und dadurch die Kontraktion der Herzkammern, was Herzinfarkte auslösen kann.
Durch die Lungenüberblähung wird das Zwerchfell nach unten gedrückt und es kommt zu einem Zwerchfelltiefstand. Der wichtigste Atemmuskel weist eine eingeschränkte Beweglichkeit auf und kann die Luft nicht mehr effizient einziehen. Die anderen Atemhilfsmuskeln müssen mehr Arbeit leisten und werden überlastet. Dies kann zu verschiedenen Beschwerden im Oberkörper führen.
Skeletale Muskuläre Dysfunktion, vor allem der Hüft- und Oberschenkelmuskulatur und der Oberarme. Es kommt zu schneller muskulärer Ermüdung, wodurch die Kurzatmigkeit verstärkt werden kann. Typ 1 Muskelfasern werden durch Typ 2 Muskelfasern ersetzt, was27 mehr oxidativen Stress sowie entzündliche Veränderungen in der Muskelmasse bedeutet 27
Insulinresistenzen können sich durch die systemische Entzündung entwickeln was die Wahrscheinlichkeit für eine Diabetes vergrössert.
Fast 70% aller COPD-Patienten erkranken zudem an Osteoporose.25
Depressionen sind auch weit verbreitete Folgen einer COPD-Diagnose.25
Die meisten moderat-schwer erkrankten COPD-Patienten entwickeln Pulmonale Hypertonie. Jede Exazerbation lässt den Druck um 20mmHg ansteigen.25
MYTHEN
Nur Raucher bekommen COPD
Epidemiologische Studien zeigen, dass 65% der COPD-Patienten auf der Welt keine Raucher sind. 2,3 Rauchen ist zwar der grösste und schwerwiegendste Risikofaktor für die Entstehung von COPD, jedoch müssen auch die anderen Faktoren in Betracht gezogen werden.
Im Vergleich zu Nichtrauchern, die an COPD erkranken, haben Raucher stärkere Symptome und einen schwereren Krankheitsverlauf sowie ein höheres Risiko auf systemische Entzündungen. Hinzu kommen Lungenkrebs und kardiovaskuläre Erkrankungen was bei Nichtrauchern nicht der Fall ist.4 COPD-Erkrankte, die Raucher sind, haben ausserdem eine höhere Sterberate.
Wenn man schon COPD hat, lohnt es sich nicht mehr, mit dem Rauchen aufzuhören
Langzeitstudien zeigen, dass das Aufhören des Rauchens auf lange Sicht den Krankheitsverlauf um 25% verbessern kann.7
COPD-Patienten dürfen keinen Sport machen und sollten körperliche Anstrengung vermeiden
Die Schäden an der Lunge können durch Sport nicht behoben oder verbessert werden. Sport ist jedoch wichtig, um den Verlauf der Krankheit zu begünstigen und Verschlechterungen zu verlangsamen. Des weiteren können Symptome gelindert werden und die Lebensqualität verbessert werden. Auf dieses Thema gehen später genauer ein.
Asthma und COPD ist das gleiche
Bei manchen Patienten koexistieren Asthma und COPD, genannt Asthma-COPD Overlap Syndrome (ACOS).4 Die Krankheiten haben gemeinsam, dass es sich bei beiden um eine chronische Atemwegserkrankung handelt. Es sind jedoch definitiv zwei eigenständige und unterschiedliche Krankheiten.
HÄUFIG GESTELLTE FRAGEN
Kann ich trainieren trotz Sauerstoffgerät?
Eine Sauerstoffsupplementierung mittels eines mobilen Sauerstoffgerätes ist für das Training kein Hindernis. Es kann sogar die Leistung steigern und dadurch eine höhere Trainingsintensität ermöglichen.15 Der Sauerstoffgehalt im Blut wird, wie oben beschrieben, regelmässig kontrolliert. Für das Training muss der Patient sein eigenes Sauerstoffgerät mitbringen und falls möglich auch einen eigenen Pulsoxymeter.
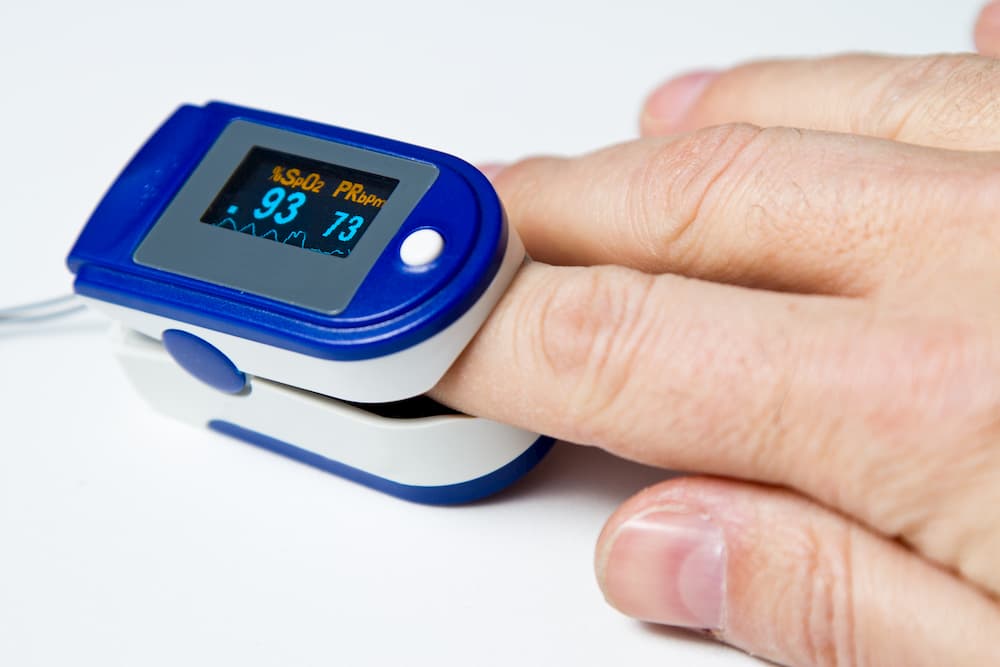
Gebrauch eines Pulsoximeters
Der Pulsoximeter misst den prozentuellen Sauerstoffgehalt im Blut. Die Messung funktioniert ganz unkompliziert über den Zeigefinger. Der Wert hilft bei der Überwachung des Trainings.
Eine optimale Sauerstoffsättigung bei einem gesunden Erwachsenen liegt zwischen 95 und 100%. Sollte die Sättigung unter 90% gelangen, sollte man entweder die Belastung und Trainingsintensität vermindern oder die Pausen verlängern. Bei einer Sättigung <88% sollte die Belastung abgebrochen werden.
Vor weiterer Belastung sollte der Wert wieder >90% oder optimal >95% sein. Wenn nach 2-3 Minuten keine Aufsättigung stattgefunden hat, sollte man die Belastung reduzieren oder das Training abbrechen.
Ist unter Belastung keine Sauerstoffsättigung >90% möglich, sollte das Training unter Sauerstoffgabe erfolgen.
PRÄVENTION
Auch präventiv kann man einiges unternehmen, um das Risiko, an COPD zu erkranken, zu senken.
Pneumokokkenimpfungen und Grippeimpfungen senken das Risiko, an Atemwegsinfektionen zu erkranken und werden somit bei Risikopatienten empfohlen.3 Die Grippeimpfung schützt zudem vor schweren Erkrankungen8, Tod9, Herzinfarkten10 und verringert die Anzahl an Exazerbationen.9 Die Pneumokokkenimpfung wird empfohlen für alle Patienten über 65 Jahren.3 Ebenfalls senkt eine Covidimpfung das Risiko, am viralen Atemwegsinfekt Covid-19 zu erkranken. Hierdurch wird also der Risikofaktor -Vorgeschichte von Atemwegsinfekten – minimiert.
Zur weiteren Minimierung der übrigen beeinflussbaren Risikofaktoren, ist eine Stärkung des Immunsystems wichtig, sowie gesunde Ernährung und viel Bewegung, Krafttraining und Ausdauertraining.
BEHANDLUNGSMÖGLICHKEITEN
Eine pharmazeutische Behandlung kann die Symptome lindern, die Frequenz und schwere der Exazerbationen reduzieren und den Gesundheitsstatus verbessern.4 Hier werden Kortikosteroide zur Inhalation, Langzeitsauerstofftherapien oder der Basistherapie –Bronchodilator, welcher dauerhaft wirksam ist, verwendet. LAMA und LABA zur Inhalation), um die Lungenfunktion zu verbessern und die Bronchien zu weiten. Für die physiotherapeutische Behandlung ist es wichtig, uns die Medikation mitzuteilen, da diese Auswirkungen auf die Behandlung hat. Beispielsweise hat eine langfristige Vergabe von kortisonhaltigen Medikamenten negative Auswirkungen auf die Qualität und dadurch die Belastbarkeit von Muskelgewebe, Bindegewebe, Bändern, Knochen etc., worauf wir Rücksicht nehmen müssen.
Ausserdem gibt es verschiedene Operationsmöglichkeiten, die die Atemnot verringern und somit Lebensqualität und Belastbarkeit verbessern. Es sind jedoch weitere Studien nötig, um zu definieren für welche Patientengruppe sich diese Interventionen am besten eignen. Bei der Lungenvolumen-Reduktions-Operation oder Bullektomie werden überblähte Teile der Lunge selektiv entfernt.
Mittels bronchoskopischer Techniken, bei welcher eine Kamera in die Lunge eingeführt wird, kann auch eine endoskopische Lungenvolumenreduktion durchgeführt werden.
Hierbei können bei einem vorhandenen Lungenemphysem Ventile in die Bronchien implantiert werden, die sich während der Einatmung verschliessen und der Ausatmung öffnen wodurch sich das Lungengebiet entleeren kann.
In besonders zerstörten Lungenarealen kann mit Heissdampf eine örtlich begrenzte Entzündung ausgelöst werden, die dazu führt, dass diese Bereiche sich verkleinern und somit indirekt den Raum für gesunde Lungenabschnitte und das Zwerchfell vergrössern.
Ob und welche pharmazeutische oder operative Behandlungstechnik für dich in Frage kommt, besprichst du am besten mit deinem behandelnden Lungenfacharzt. Für die Behandlung ist es wichtig, uns darüber zu informieren.
Die im früheren Abschnitt aufgelisteten Komorbiditäten spielen in der Behandlung eine grosse Rolle. Dein Physiotherapeut sollte in jedem Fall über Diagnosen oder passende Symptome aufgeklärt werden. Weitere Erkrankungen müssen mitbehandelt werden, da dies wichtig ist für die Steigerung der Lebensqualität und Lebenserwartung.
Falls du Raucher bist raten wir dir dringend, damit aufzuhören. Langzeitstudien zeigen, dass ein Rauchstopp auf lange Sicht den Krankheitsverlauf um 25% verbessern kann.7 Hierbei ist es noch umstritten, welche Nikotinersatzprodukte oder E-Zigaretten alternativ in Frage kommen. Es werden viele Rauchstopp-Programme angeboten.
WAS KÖNNEN SIE ALS PATIENT ODER ARZT BEI/VON UNS ERWARTEN?
Physiotherapeutische Massnahmen tragen sowohl präventiv als auch zur Symptomlinderung, Verbesserung der Lebensqualität und der Lebenserwartung einen sehr wichtigen Teil zur Behandlung bei.
Wie bei jedem unserer (neuen) Patienten erwartet dich zu Beginn der ersten Therapiesitzung ein ausführliches Anamnesegespräch. Wir nehmen die gesundheitliche Vorgeschichte, vorhandene Risikofaktoren und Nebendiagnosen, den Krankheitsverlauf und den Einfluss der Erkrankung auf das alltägliche Leben auf. Hierfür können folgende Fragelisten ausgefüllt werden welche uns einen guten Überblick verschaffen:
- Modified British Medical Research Council Questionnaire4
- COPD Assessment Test (CAT)
Zudem wird gemeinsam mit dem Patienten ein individuelles Anforderungsprofil erstellt, welches speziell auf die alltäglichen Anforderungen abgestimmt wird. Ziel davon ist es, einen klar objektiv definierten IST- Standpunkt zu erhalten und eine erste Planung für den zu erreichenden Soll-Zustand zu formulieren. Die Therapie wird laufend überwacht und bewertet, um jederzeit über den aktuellen Zustand des Patienten informiert zu sein.
Um die Therapie noch effizienter zu gestalten und das volle Potenzial aus der Behandlung schöpfen zu können, bieten wir dir die Möglichkeit der erweiterten Therapiezeit an. Ziel dieser Zusatzleistung ist es, unser Behandlungspotential voll auszuschöpfen, eine qualitativ hochwertige Therapie zu garantieren und so das Therapieergebnis zu optimieren. Durch das erweiterte Konzept können unsere Therapeuten deshalb noch effizienter am Therapieprozess arbeiten.
Des weiteren verwenden wir verschiedene Tools, um den IST-Standpunkt des Patienten zu messen und im Laufe der Behandlung zu evaluieren. Hierfür werden am Anfang der Behandlung und zur Evaluation auch im weiteren Behandlungsverlauf verschiedene Assessments gemacht.
Um die Belastungstoleranz zu bestimmen, können der 6 Minuten Gehtest oder der Sit To Stand Test ausgeführt werden.
Beim 6 Minuten Gehtest wird die maximal erreichte Distanz innerhalb von 6 Minuten gemessen.
Beim Sit To Stand Test werden die korrekt ausgeführten Aufstehwiederholungen von einem Stuhl innerhalb eines definierten Zeitintervalls von 30 oder 60 Sekunden gezählt. Hier kann man ebenfalls die Zeit messen, die der Patient für die Durchführung von X Wiederholungen braucht.
Um die Muskelfunktion zu prüfen und zu evaluieren können auch noch gesondert Krafttests durchgeführt werden für die verschiedenen Muskelgruppen. Hier wird das Gewicht ermittelt, mit dem der Patient die Übung maximal zehnmal ausführen kann.
Anhand des Anamnesegespräches und des Assessments wird ein individueller Behandlungsplan erstellt. Hierfür werden gemeinsam Ziele formuliert. Hierbei sind sowohl langfristige Ziele als auch kurze Ziele für die einzelnen Phasen der Behandlung wichtig.
Für den Behandlungsplan wählen wir aus verschiedenen Behandlungsansätzen, die im Folgenden vorgestellt werden:
Lungenrehabilitation
Das Ziel einer Lungenrehabilitation ist die Verbesserung der Übungskapazität, Leistungsfähigkeit und Belastbarkeit und dadurch auch der Lebensqualität, sowie das Reduzieren von Exazerbationen.
Hierfür wird eine Kombination aus Constant Load Training (konstante Intensität) oder Ausdauertraining, Intervalltraining und Krafttraining empfohlen. Mehrere Studien belegen, dass eine Kombination dieser Trainingsmethoden signifikanten Einfluss auf die Lebensqualität, allgemeine Belastbarkeit, allgemeine physische Leistung, Kraft und Muskelmasse, Reduktion von Kurzatmigkeit, Reduktion von Krankenhausaufenthalten und Sterblichkeit sowie Reduktion von Angst und Depressionen haben. 17, 18, 19, 20, 21, 31
Beim Krafttraining ist es wichtig, sowohl die oberen als auch die unteren Extremitäten zu trainieren.12 Verbesserte Kraft in den Armen bewirkt auch eine bessere Ausdauer und Belastbarkeit für Aktivitäten des Oberkörpers und der Arme. 12
Da der Muskelabbau in den Beinen durch COPD stark beschleunigt wird, ist es wichtig die Muskulatur der Beine zu stärken und zu erhalten.
Wie oben beschrieben, vermindert sich die Kraft der Atemmuskulatur. Die Muskeln sind oft stark überlastet, da sie mehr Kraft aufwenden müssen um die Atmung zu unterstützen. Daher ist ein Training dieser Muskeln sehr wichtig, um diese belastbarer zu machen.
Alle Patienten mit chronischem Husten, unabhängig vom Kontinenzstatus, sollten lernen die Beckenbodenmuskulatur vor forcierter Ausatmung und Husten anzuspannen.12
Krafttrainingsmethode
Beim Krafttraining liegt der Fokus darauf, als Ziel die Reduktion von COPD bedingten körperlichen Einschränkungen zu erreichen.
Im Vergleich zu Ausdauertraining ist die Kurzatmigkeit hier weniger ein einschränkender Faktor.
Es wird ein dynamisches Muskeltraining für die obere und untere Extremität ausgeführt.
Hierfür wird die Belastung wieder langsam gesteigert zwischen 50-85% des 1RM. Das 1 RM ist das Gewicht, mit dem man die jeweilige Übung nur 1-mal ausführen kann.
Sobald der Patient 1-2 Wiederholungen mehr durchführen kann als 6-12 Wiederholungen, kann das Gewicht um 2-10% gesteigert werden.
Bei uns ist ausserdem ein Bloodflow Restriction Training möglich, wodurch nur bei 30% der Maximalkraft (1RM) die gleichen Trainingseffekte erzielt werden können. Dies ist eine gute Alternative für Patienten, die nicht stark belastbar sind.
Des weiteren ist ein Krafttraining der Einatemmuskulatur wichtig. 22,23
Dies sollte 5-7-mal die Woche durchgeführt werden für 5-20min. Hierbei können verschiedene Atemtrainer gebraucht werden, die im Abschnitt Atemtechniken erläutert und vorgestellt werden.
Das Ziel einer Lungenrehabilitation ist die Verbesserung der Übungskapazität, Leistungsfähigkeit und Belastbarkeit und dadurch auch der Lebensqualität, sowie das Reduzieren von Exazerbationen und Sterblichkeit.
Hierfür wird eine Kombination aus Constant Load Training (konstante Intensität) oder Ausdauertraining, Intervall Training und Krafttraining empfohlen.17,18,19,20,21
Beim Krafttraining liegt der Fokus auf einem Oberkörpertraining. Verbesserte Kraft in den Armen bewirkt auch eine bessere Ausdauer und Belastbarkeit für Aktivitäten des Oberkörpers und der Arme.12 Es wird aber insgesamt ein Training der allgemeinen Muskulatur der oberen und unteren Gliedmaßen empfohlen.12
Wie oben beschrieben, vermindert sich die Kraft der Atemmuskulatur. Die Muskeln sind oft stark überlastet, da sie mehr Kraft aufwenden müssen um die Atmung zu unterstützen. Daher ist ein Training dieser Muskeln sehr wichtig, um diese belastbarer zu machen.
Alle Patienten mit chronischem Husten, unabhängig vom Kontinenz Status, sollten lernen die Beckenbodenmuskulatur vor forcierter Ausatmung und Husten anzuspannen.12
Ausdauertrainingsmethode
Das Ausdauertraining sollte im besten Fall hochintensiv sein, damit grösstmögliche physiologische Anpassungen entstehen. Viele Patienten mit fortgeschrittener COPD sind leider nicht in der Lage ein so hoch intensives Training durchzuführen. Für diese Patientengruppe ist ein Intervalltraining eine Alternative.
Das Ausdauertraining findet auf einem Laufband oder Fahrradergometer statt.
Empfehlenswert ist eine Frequenz von 3-4-mal die Woche. Die Intensität des Trainings wird angepasst an den Patienten und dann langsam gesteigert und sollte ca. bei 70-85% VO2max (maximale Sauerstoffaufnahme) durchgeführt werden. Auch der Umfang wird langsam gesteigert. Die ersten Einheiten starten bei 10-15 Minuten und werden auf 45-60 Minuten gesteigert. Die wahrgenommene Anstrengung wird mittels der Borg Skala gemessen und sollte nicht mehr als 4-6 betragen. Verschiedene Atemtechniken können hier dazu beitragen, die Atemfrequenz zu reduzieren und die Leistungsausdauer zu steigern.16
Intervalltrainingsmethode
Bei Patienten mit schweren Verläufen produziert ein Intervalltraining im Vergleich zur Dauermethode weniger Symptome während der Belastung und hat daher einen höheren Stellenwert.
Man kann verschiedene Intervalle gebrauchen. Zum Beispiel 30 Sekunden Belastung gefolgt von 30 Sekunden Pause oder 20 Sekunden Belastung gefolgt von 40 Sekunden Pause. Diese Trainingsmethode sollte ebenfalls 3-4-mal die Woche stattfinden. Die Intensität des Trainings wird angepasst an den Patienten und dann langsam gesteigert. Auch der Umfang wird langsam gesteigert. Die ersten Einheiten starten bei 10-20 Minuten und werden auf 45-60 Minuten gesteigert. Die wahrgenommene Anstrengung wird mittels der Borg Skala gemessen und sollte nicht mehr als 4-6 betragen. Verschiedene Atemtechniken können hier dazu beitragen, die Atemfrequenz zu reduzieren und die Leistungsausdauer zu steigern.
Edukation, Selbstmanagement
Bei der Behandlung von COPD ist ein gutes Selbstmanagement die beste Grundlage für die Therapie. Dem Patienten wird deutlich gemacht, wie er sein Verhalten und seinen Lebensstil ändern kann, um die Risikofaktoren für eine Verschlechterung des Krankheitsverlaufes zu minimieren und die Lebensqualität zu steigern. Des weiteren ist es wichtig, dass der Patient lernt, Exazerbationen rechtzeitig zu erkennen, während des Trainings auf seinen Körper zu hören, seine Belastungsgrenzen zu erkennen, Entscheidungen zu treffen, wann Hilfe geholt werden sollte und persönliche Ziele zu formulieren.
Ernährung30
In der physiotherapeutischen Behandlung weisen wir darauf hin, dass eine COPD-Erkrankung häufig mit erheblichem Gewichtsverlust und einem Verlust an Muskelmasse einhergeht. Dies geschieht durch den erhöhten Energiebedarf, den die chronisch entzündlichen Prozesse und die überlastete Atemmuskulatur durch die geschädigte Lunge haben. Der Körper baut durch den Energiemangel zunehmend Muskeleiweiss ab, um die verloren gegangene Energie zurück zu gewinnen was zum Abbau von Muskelmasse führt.
Um dem vorzubeugen, ist richtige Ernährung ein wichtiger Bestandteil der Behandlung und kann bei Bedarf von unserer Ernährungsberaterin gecoacht und begleitet werden. Studien zeigen ausserdem, dass der Ernährungszustand und die Sterblichkeit in klarem Zusammenhang stehen. Untergewicht reduziert die durchschnittliche Überlebenszeit und ein normales Gewicht verlängert die Lebenserwartung.30 Im Allgemeinen ist es wichtig, auf eine vollwertige und bei Untergewicht hochkalorische Ernährung zu achten und vor allem eine gute Eiweisszufuhr einzuhalten, die essentiell für Muskelaufbau und –erhalt ist. Studien belegen gute Ergebnisse bei der Zufuhr von Trinknahrung zwei- bis dreimal täglich zusätzlich zu den Mahlzeiten. Wichtig ist ebenfalls eine ausreichende Flüssigkeitszufuhr, um das Abhusten zu erleichtern.
Mehrere kleine statt wenige grosse Mahlzeiten über den Tag verteilt zu sich zu nehmen ist bekömmlicher. Ausreichend Vitamine, Omega 3-Fettsäuren (als Nahrungsergänzungsmittel) und Kalzium sind wichtig für COPD-Patienten. Ebenso wie reichlich Obst, Gemüse und Vollkornprodukte. Alkoholische Getränke sollten vermieden werden, da sie die Harnsäurekonzentration im Blut erhöhen. Harnsäure kann zu einer Verschlechterung von COPD führen, da sie die Lungenfunktion und die körperliche Belastbarkeit reduziert. Dadurch entstehen vermehrt Exazerbationen und kardiovaskuläre Begleiterkrankungen.
Atemtherapie15
Es gibt einige Techniken bei der Atmung, die die Atemnot reduzieren können und die Atmung bei Belastung verbessern können. Des weiteren können Atemtechniken gegen Panik und Angst helfen sowie bei der Entfernung von Sekret.
Die Lippenbremse ist eine Atemtechnik um während Anstrengungen die Atemfrequenz und Atemnot zu senken und die Erholung zu beschleunigen. Ebenfalls ist eine gute Kontrolle des Tempos der Atmung wichtig. Im weiteren ist es hilfreich eine entspannte, langsame, tiefe Atemtechnik zu erlernen, sowie dabei eine gute Haltung oder Lagerung einzunehmen. Entspannungsstrategien können helfen, Panik und Angst bei Kurzatmigkeit zu reduzieren.
Atemwegsreinigungstechniken
Es gibt verschiedene Atemwegsreinigungstechniken, die dazu dienen, die Lunge zu belüften, die Durchblutung zu fördern und das Sekret zu mobilisieren.15 Die Strategien beinhalten sowohl manuelle Techniken und Haltungsdrainagen, die durch den Therapeuten ausgeführt werden, als auch Techniken, die dem Patienten beigebracht werden können, damit diese Zuhause selbstständig durchgeführt werden können. Hierunter fallen zum Beispiel die autogene Drainage, Huffing und das Erlernen eines Atemzirkels.
Ausserdem gibt es verschiedenste PEP-Geräte (positive expiratory pressure) bei denen meist gegen Widerstand ausgeatmet werden muss, wodurch Vibrationen entstehen, die den Bronchialschleim lösen. Des weiteren kann laut einer aktuellen Studie durch ein regelmässiges Training, von 5-7-mal für 5-20min, mit diesen Geräten die Atemausdauer um 86%, die Lebensqualität um 21% und die Einatemungsmuskulatur um 55% verbessert werden.29
QUELLENANGABE
- Agustí, A., Vogelmeier, C., & Faner, R. (2020). COPD 2020: changes and challenges. American Journal of Physiology-Lung Cellular and Molecular Physiology, 319(5), L879-L883.
- Salvi, S. S., & Barnes, P. J. (2009). Chronic obstructive pulmonary disease in non-smokers. The lancet, 374(9691), 733-743.
- Gupta, N., Malhotra, N., & Ish, P. (2021). GOLD 2021 guidelines for COPD—what’s new and why. Advances in respiratory medicine, 89(3), 344-346.
- Vogelmeier, C. F., Criner, G. J., Martinez, F. J., Anzueto, A., Barnes, P. J., Bourbeau, J., … & Agusti, A. (2017). Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD executive summary. American journal of respiratory and critical care medicine, 195(5), 557-582.
- Silva, G. E., Sherrill, D. L., Guerra, S., & Barbee, R. A. (2004). Asthma as a risk factor for COPD in a longitudinal study. Chest, 126(1), 59-65.
- World Health Organization. (1997). α_1-antitrypsin deficiency: Memorandum from a WHO meeting. Bull World Health Organ, 75, 397-415.
- van Eerd, E. A., van der Meer, R. M., van Schayck, O. C., & Kotz, D. (2016). Smoking cessation for people with chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews, (8).
- Wongsurakiat, P., Maranetra, K. N., Wasi, C., Kositanont, U., Dejsomritrutai, W., & Charoenratanakul, S. (2004). Acute respiratory illness in patients with COPD and the effectiveness of influenza vaccination: a randomized controlled study. Chest, 125(6), 2011-2020.
- Poole, P., Chacko, E. E., Wood-Baker, R., & Cates, C. J. (2006). Influenza vaccine for patients with chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews, (1).
- Huang, C. L., Nguyen, P. A., Kuo, P. L., Iqbal, U., Hsu, Y. H. E., & Jian, W. S. (2013). Influenza vaccination and reduction in risk of ischemic heart disease among chronic obstructive pulmonary elderly. Computer methods and programs in biomedicine, 111(2), 507-511.
- Pauwels, R. A., Löfdahl, C. G., Laitinen, L. A., Schouten, J. P., Postma, D. S., Pride, N. B., & Ohlsson, S. V. (1999). Long-term treatment with inhaled budesonide in persons with mild chronic obstructive pulmonary disease who continue smoking. New England Journal of Medicine, 340(25), 1948-1953.
- Velloso, M., do Nascimento, N. H., Gazzotti, M. R., & Jardim, J. R. (2013). Evaluation of effects of shoulder girdle training on strength and performance of activities of daily living in patients with chronic obstructive pulmonary disease. International journal of chronic obstructive pulmonary disease, 8, 187.
- Seemungal, T. A., Donaldson, G. C., Bhowmik, A., Jeffries, D. J., & Wedzicha, J. A. (2000). Time course and recovery of exacerbations in patients with chronic obstructive pulmonary disease. American journal of respiratory and critical care medicine, 161(5), 1608-1613.
- Seemungal, T. A., Donaldson, G. C., Paul, E. A., Bestall, J. C., Jeffries, D. J., & Wedzicha, J. A. (1998). Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. American journal of respiratory and critical care medicine, 157(5), 1418-1422.
- Bott, J., Blumenthal, S., Buxton, M., Ellum, S., Falconer, C., Garrod, R., … & White, J. (2009). Guidelines for the physiotherapy management of the adult, medical, spontaneously breathing patient. Thorax, 64(Suppl 1), i1-i52.
- Gloeckl, R., Marinov, B., & Pitta, F. (2013). Practical recommendations for exercise training in patients with COPD. European Respiratory Review, 22(128), 178-186.
- Gosselink, R. I. K., Troosters, T., & Decramer, M. (1996). Peripheral muscle weakness contributes to exercise limitation in COPD. American journal of respiratory and critical care medicine, 153(3), 976-980.
- Hamilton, A. L., Killian, K. J., Summers, E., & Jones, N. L. (1995). Muscle strength, symptom intensity, and exercise capacity in patients with cardiorespiratory disorders. American journal of respiratory and critical care medicine, 152(6), 2021-2031.
- Troosters, T., Casaburi, R., Gosselink, R., & Decramer, M. (2005). Pulmonary rehabilitation in chronic obstructive pulmonary disease. American journal of respiratory and critical care medicine, 172(1), 19-38.
- O’Shea, S. D., Taylor, N. F., & Paratz, J. D. (2009). Progressive resistance exercise improves muscle strength and may improve elements of performance of daily activities for people with COPD: a systematic review. Chest, 136(5), 1269-1283.
- Simpson, K., Killian, K., McCartney, N., Stubbing, D. G., & Jones, N. L. (1992). Randomised controlled trial of weightlifting exercise in patients with chronic airflow limitation. Thorax, 47(2), 70.
- Gosselink, R., De Vos, J., Van Den Heuvel, S. P., Segers, J., Decramer, M., & Kwakkel, G. (2011). Impact of inspiratory muscle training in patients with COPD: what is the evidence?. European Respiratory Journal, 37(2), 416-425.
- Lötters, F., Van Tol, B., Kwakkel, G., & Gosselink, R. (2002). Effects of controlled inspiratory muscle training in patients with COPD: a meta-analysis. European Respiratory Journal, 20(3), 570-577.
- Brashier, B. B., & Kodgule, R. (2012). Risk factors and pathophysiology of chronic obstructive pulmonary disease (COPD). J Assoc Physicians India, 60(Suppl), 17-21.
- Fabbri, L. M., Luppi, F., Beghé, B., & Rabe, K. F. (2008). Complex chronic comorbidities of COPD. European Respiratory Journal, 31(1), 204-212.
- Kabitz, H. J., & Windisch, W. (2007). Diagnostik der Atemmuskelfunktion: state of the art. Pneumologie, 61(09), 582-587.
- de Oca, M. M., Torres, S. H., Gonzalez, Y., Romero, E., Hernández, N., Mata, A., & Tálamo, C. (2006). Peripheral muscle composition and health status in patients with COPD. Respiratory medicine, 100(10), 1800-1806.
- Celli, B. R., Cote, C. G., Marin, J. M., Casanova, C., Montes de Oca, M., Mendez, R. A., … & Cabral, H. J. (2004). The body-mass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. New England Journal of Medicine, 350(10), 1005-1012.
- Belli, S., Prince, I., Savio, G., Paracchini, E., Cattaneo, D., Bianchi, M., … & Balbi, B. (2021). Airway clearance techniques: the right choice for the right patient. Frontiers in medicine, 8, 544826.
- Steinkamp, G. (2003). COPD, die Systemerkrankung: Ernährung: zu wenig beachtet und noch ungelöst. Pneumologie, 57(11), 681-689.